1. Kiểm soát chất lượng sinh phẩm, thiết bị xét nghiệm sàng lọc các tác nhân lây truyền qua đường máu
Các phòng xét nghiệm phải kiểm soát chất lượng sinh phẩm:
a) Lựa chọn thiết bị, sinh phẩm xét nghiệm:
- Kỹ thuật ELISA hoặc Hóa phát quang: Sinh phẩm sàng lọc HBsAg: phát hiện HBsAg ít nhất ở nồng độ 0,5 ng/ml; sinh phẩm sàng lọc HIV: phát hiện được kháng thể HIV-1 (bao gồm nhóm M, O), HIV-2 và kháng nguyên p24; sinh phẩm sàng lọc HCV: phát hiện được các mẫu chuẩn dương tính yếu;
- Kỹ thuật xét nghiệm NAT: phát hiện HCV-NAT 5.000 IU/mL, HIV-NAT 10.000 IU/mL và HBV-NAT 1.000 IU/ml ở từng mẫu đơn lẻ;
- Xét nghiệm sàng lọc giang mai: phát hiện được các mẫu chuẩn dương tính yếu.
b) Mỗi thiết bị xét nghiệm, mỗi lô sinh phẩm phải có giấy xác nhận chất lượng của nhà sản xuất trước khi sử dụng lần đầu.
c) Kiểm tra chất lượng sinh phẩm trước khi sử dụng lần đầu mỗi lô mới nhận và định kỳ sau từ 3 đến 6 tháng sử dụng mỗi lô:
- Phạm vi áp dụng: Với các xét nghiệm sàng lọc HIV, HBV, HCV, giang mai;
- Số mẫu chuẩn tối thiểu sử dụng để kiểm tra: Gồm 20 mẫu âm tính và 10 mẫu dương tính đã được khẳng định và không có nguồn gốc từ cùng nhà sản xuất sinh phẩm.
2. Thực hiện kiểm tra chất lượng xét nghiệm sàng lọc các tác nhân lây truyền qua đường máu
a) Xét nghiệm đồng thời chứng âm và chứng dương trong bộ sinh phẩm cho mỗi lượt xét nghiệm theo hướng dẫn của nhà sản xuất sinh phẩm;
b) Xét nghiệm đồng thời mẫu kiểm tra chất lượng nội bộ:
- Mẫu kiểm tra chất lượng nội bộ là mẫu đã khẳng định kết quả và không thuộc bộ sinh phẩm sử dụng để xét nghiệm;
- Phạm vi áp dụng: Với xét nghiệm sàng lọc HIV, HBV, HCV, giang mai, CMV.
c) Sử dụng tối thiểu 01 mẫu kiểm tra chất lượng nội bộ khi thực hiện:
- Mỗi lượt xét nghiệm sử dụng kỹ thuật ngưng kết, kỹ thuật NAT;
- Mỗi phiến xét nghiệm sử dụng kỹ thuật ELISA;
- Trong thời gian không quá 24 giờ khi sử dụng kỹ thuật hóa phát quang.
d) Kết quả thực hiện với các mẫu kiểm tra chất lượng nội bộ phải được lưu giữ, thống kê, phân tích nhằm phát hiện kịp thời các bất thường khi thực hiện xét nghiệm.
3. Tham gia các chương trình đánh giá chất lượng từ bên ngoài, đánh giá năng lực phòng xét nghiệm
Các phòng xét nghiệm sàng lọc đơn vị máu, thành phần máu phải tham gia các chương trình đánh giá chất lượng từ bên ngoài được tổ chức ở trong nước và quốc tế, trong đó có các xét nghiệm HIV, viêm gan vi rút B, viêm gan vi rút C, giang mai.
4. Phương cách xét nghiệm sàng lọc và xử lý đơn vị máu, thành phần máu
a) Phòng xét nghiệm ở cơ sở truyền máu thuộc cơ sở khám chữa bệnh:
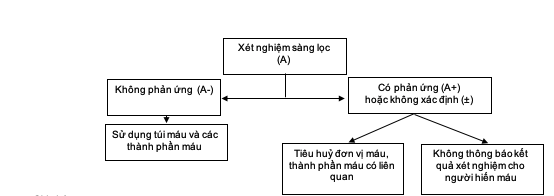
Ghi chú:
(A) : mẫu thử nghiệm
(A+): kết quả của mẫu A phản ứng
(A-) : kết quả của mẫu A không phản ứng
(A±): kết quả của mẫu A không xác định
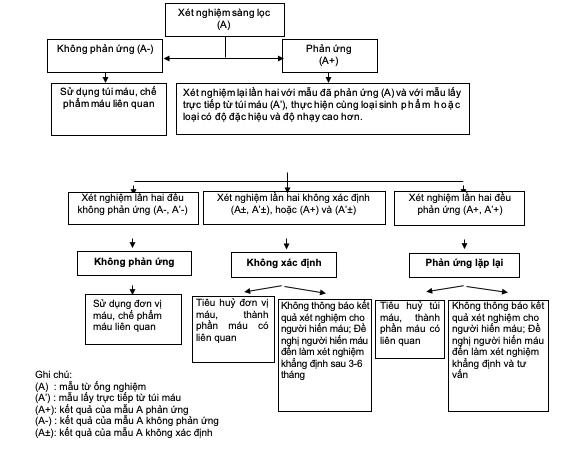
b) Phòng xét nghiệm thuộc các trung tâm truyền máu:
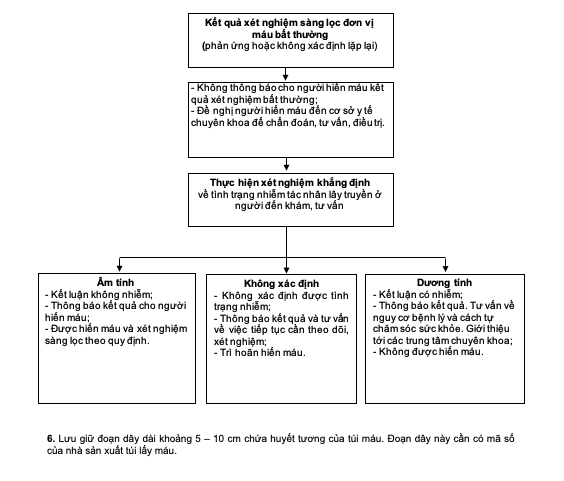
5. Thực hiện xét nghiệm khẳng định tình trạng nhiễm tác nhân lây truyền ở người hiến máu
a) Chỉ thực hiện xét nghiệm khẳng định khi người hiến máu đến khám, tư vấn tại các cơ sở xét nghiệm chẩn đoán theo quy định.
b) Phương cách xét nghiệm khẳng định đối với mỗi loại tác nhân lây truyền phải phù hợp với các quy định có liên quan của Bộ Y tế và được Lãnh đạo cơ sở xét nghiệm phê duyệt.
- Đăng nhập để gửi ý kiến

